ANSM - Mis à jour le : 10/03/2025
Codéine/Extrait fluide d’erysimum
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que POLERY ADULTES SANS SUCRE, sirop édulcoré à la saccharine sodique et au cyclamate de sodium et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre POLERY ADULTES SANS SUCRE, sirop édulcoré à la saccharine sodique et au cyclamate de sodium ?
3. Comment prendre POLERY ADULTES SANS SUCRE, sirop édulcoré à la saccharine sodique et au cyclamate de sodium ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver POLERY ADULTES SANS SUCRE, sirop édulcoré à la saccharine sodique et au cyclamate de sodium ?
6. Contenu de l’emballage et autres informations.
La codéine est un antitussif (réduit la toux).
L’erysimum est un extrait de plante utilisé en traitement de la toux.
Ce médicament est utilisé pour calmer les toux sèches et les toux d’irritation chez l’adulte et l’adolescent de plus de 15 ans.
· Si vous êtes allergique aux substances actives (la codéine, l’extrait fluide d’érysimum) ou à l’un des autres composants contenus dans ce médicament mentionnés dans la rubrique 6.
· Si vous avez une toux causée par un asthme.
· Si vous avez une insuffisance respiratoire (diminution des capacités de la fonction respiratoire).
· Si vous allaitez (voir le paragraphe « Allaitement »).
· Si vous savez que votre organisme métabolise très rapidement la codéine en morphine.
· En association avec un médicament qui soigne la narcolepsie (troubles du sommeil), contenant de l’oxybate de sodium.
· D’une façon générale, la codéine contenue dans ce médicament est contre-indiquée chez les enfants de moins de 12 ans
Avertissements et précautions
Il existe 2 types de toux : les toux sèches et les toux grasses. Vous ne devez pas traiter une toux grasse en utilisant ce médicament. En effet, la toux grasse est un moyen de défense naturelle nécessaire à l’évacuation des liquides qui se trouvent dans les bronches.
Ce médicament contient de la codéine. La prise régulière et prolongée de codéine peut entraîner une addiction et un mésusage donnant lieu à un surdosage pouvant entrainer le décès. Ne prenez pas ce médicament plus longtemps que nécessaire. Ne donnez pas ce médicament à une autre personne. Respectez les doses et la durée de traitement recommandées en rubrique 3.
La codéine est transformée en morphine par une enzyme dans le foie. La morphine est la substance qui produit les effets de la codéine. Certaines personnes possèdent des variantes de cette enzyme, ce qui peut avoir un impact différent selon les personnes. Ainsi chez certaines d’entre elles, la codéine n'est que très peu ou pas du tout transformée en morphine par l'organisme. La codéine administrée n’aura alors pas d'effet sur leur toux. D’autres personnes sont plus susceptibles de ressentir des effets indésirables graves, car une très grande quantité de morphine est produite. Si vous remarquez l’un des effets indésirables suivants, vous devez arrêter de prendre ce médicament et consulter immédiatement un médecin : respiration lente ou superficielle, confusion mentale, somnolence, rétrécissement des pupilles, nausées ou vomissements, constipation, perte d’appétit.
Certains médicaments tels que la quinidine, la fluoxétine, la paroxétine, le bupropion, le cinacalcet, la terbinafine ou la duloxétine peuvent réduire l’efficacité de la codéine et entrainer un ensemble de symptôme traduisant un état de manque (syndrome de sevrage).
Adressez-vous à votre médecin ou pharmacien avant de prendre POLERY ADULTES SANS SUCRE :
· Si vous êtes ou avez déjà été dépendant aux opioïdes, à l'alcool, à des médicaments délivrés sur ordonnance ou à des substances illicites.
· Si vous avez une maladie au long cours des bronches et des poumons avec une toux et des crachats.
· Si vous avez une maladie au long cours du foie et/ou du rein.
· Si vous n’avez plus de vésicule biliaire (car la codéine peut provoquer des douleurs abdominales aigües).
· Si vous avez une pression élevée à l’intérieur du crâne (hypertension intracrânienne), ce médicament peut encore augmenter cette pression.
Pendant le traitement, prévenez votre médecin :
Si votre toux devient grasse, avec un encombrement, des crachats ou de la fièvre.
Si vous êtes sportif : la codéine contenue dans cette spécialité peut être métabolisée en morphine qui peut induire une réaction positive des tests pratiqués lors des contrôles antidopages.
Enfants et adolescents
En raison de la présence de codéine, POLERY ADULTES SANS SUCRE n’est pas recommandé chez les adolescents dont la fonction respiratoire est altérée.
POLERY ADULTES SANS SUCRE n’est pas adapté aux enfants et adolescents de moins de 15 ans.
D’une façon générale, la codéine est contre indiquée chez les enfants âgés de moins de 12 ans.
Autres médicaments et POLERY ADULTES SANS SUCRE, sirop édulcoré à la saccharine sodique et au cyclamate de sodium
Ce médicament contient un antitussif, la codéine. D’autres médicaments en contiennent ou contiennent un autre antitussif.
Ne les associez pas, afin de ne pas dépasser la dose maximale conseillée (voir la rubrique « 3. Comment prendre Polery Adultes sans sucre »).
· Ne prenez pas POLERY ADULTES SANS SUCRE si vous prenez déjà :
o un médicament contre la douleur ayant pour substance active la nalbuphine ou la méthadone,
o un médicament pour traiter une dépendance à la drogue (la buprénorphine, la méthadone) ou à l’alcool (naltrexone, nalmefene),
o un médicament contre la toux grasse (expectorant, mucolytique),
o un médicament contenant de l’alcool,
o un médicament pour traiter la narcolepsie (un trouble du sommeil), contenant de l’oxybate de sodium,
o certains antidepresseurs (fluoxétine, duloxétine, paroxétine),
o un médicament pour traiter les mycoses (terbinafine),
o un médicament pour traiter un dysfonctionnement thyroïdien (cinacalcet),
o un médicament pour traiter un trouble du rythme cardiaque ou le paludisme (quinidine),
o un médicament utilisé dans le sevrage tabagique (bupropion).
· Faites attention si vous prenez POLERY ADULTES SANS SUCRE en même temps que :
o un médicament atropinique (imipraminiques, neuroleptiques phénothiaziniques, antispasmodiques, certains antihistaminiques H1, antiparkinsoniens anticholinergiques, disopyramide, clozapine…) en raison du risque de constipation sévère,
o un médicament sédatif ou somnifère (neuroleptiques, anxiolytiques autres que benzodiazépines, barbituriques, hypnotiques, antidépresseurs sédatifs, antihistaminiques H1 sédatifs, antihypertenseurs centraux, baclofène et thalidomide) (voir ci-dessous),
o un médicament antidouleur puissant (de la famille des opioïdes).
L'utilisation concomitante de POLERY ADULTES SANS SUCRE et de médicaments sédatifs tels que les benzodiazépines ou des médicaments apparentés augmente le risque de somnolence, de difficultés respiratoires (dépression respiratoire), de coma et peut mettre la vie en danger. Aussi, l'utilisation concomitante ne doit être envisagée que lorsqu’il n’y a pas d'alternative de traitement.
Toutefois, si votre médecin prescrit POLERY ADULTES SANS SUCRE en association avec des médicaments sédatifs, la dose et la durée du traitement concomitant doivent être limitées par votre médecin.
Veuillez informer votre médecin de tous les médicaments sédatifs que vous prenez et suivez attentivement les recommandations de votre médecin concernant la dose qu’il prescrira. Il peut être utile d’informer vos amis ou votre famille des signes et symptômes mentionnés ci-dessus. Contactez votre médecin si vous ressentez de tels symptômes.
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
POLERY ADULTES SANS SUCRE, sirop édulcoré à la saccharine sodique et au cyclamate de sodium avec de l’alcool
Vous devez éviter la consommation de boissons alcoolisées pendant toute la durée du traitement.
Grossesse
La prise de ce médicament pendant la grossesse ne doit être envisagée que si un professionnel de santé le juge nécessaire et à condition de ne pas dépasser la durée de traitement recommandée (quelques jours) et en respectant bien les doses recommandées dans cette notice.
En fin de grossesse, la prise de ce médicament peut entraîner des problèmes de santé graves chez le nouveau-né.
Allaitement
Ne prenez pas POLERY ADULTES SANS SUCRE, tant que vous allaitez. La codéine et la morphine passent dans le lait maternel.
De trop fortes doses de codéine administrées chez les femmes qui allaitent peuvent entraîner des pauses respiratoires ou des baisses du tonus de leur nourrisson/enfant.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Ce médicament peut provoquer des somnolences dues à la présence de codéine. Il est déconseillé de conduire un véhicule ou d’utiliser une machine si vous ressentez cet effet.
Le risque de somnolence est augmenté si vous consommez des boissons alcoolisées ou des médicaments contenant de l’alcool.
POLERY ADULTES SANS SUCRE, sirop édulcoré à la saccharine sodique et au cyclamate de sodium contient :
· du parahydroxybenzoate de méthyle (E218) qui peut provoquer des réactions allergiques (éventuellement retardées),
· de l’éthanol, ce médicament contient 1,5 % de vol d’alcool (éthanol), c’est-à-dire jusqu’à 178 mg par mesure de 15 ml de sirop, ce qui équivaut à 5 ml de bière ou 2 ml de vin par mesure. La faible quantité d’alcool contenue dans ce médicament n’est pas susceptible d’entraîner d’effet notable.
· 36,5 mg de sel de benzoate par dose, ce qui équivaut à 2,4 mg/ml,
· moins de 1 mmol de sodium (23 mg) par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
· Chez l’adulte et l’adolescent de plus de 15 ans (plus de 50 kg de poids corporel)
La dose recommandée est de 1 mesure par prise (15 ml gradués sur le gobelet doseur), à renouveler si nécessaire au bout de 6 heures, sans dépasser 4 prises par jour.
Si votre toux persiste, n’augmentez pas les doses, n’ajoutez pas un autre antitussif, mais demandez conseil à votre médecin.
· Si vous êtes âgé de plus de 65 ans ou si vous avez une insuffisance hépatique (défaillance des fonctions du foie) et/ou rénale (défaillance des fonctions du rein)
Vous devez prévenir votre médecin ou votre pharmacien car la dose à utiliser doit être adaptée à votre situation.
Ce médicament vous a été personnellement prescrit dans une situation précise :
· Il peut ne pas être adapté à un autre cas.
· Ne le donnez pas à une autre personne.
Ce médicament est à prendre par voie orale. Utiliser le gobelet doseur gradué fourni dans l’étui.
L’utilisation du gobelet doseur gradué est strictement réservée à l’administration par voie orale de POLERY ADULTES SANS SUCRE. Utilisez exclusivement le gobelet doseur gradué qui est fourni avec ce médicament pour mesurer et administrer la dose.
Le gobelet doseur gradué doit être rincé et séché après chaque utilisation. Stocker le flacon et le gobelet doseur gradué ensemble dans l’étui dans un endroit inaccessible aux enfants jusqu’à l’utilisation suivante. Jeter le gobelet doseur gradué une fois le flacon terminé.
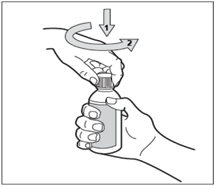
Le flacon est muni d’un bouchon sécurité-enfant. Pour ouvrir le flacon, appuyer sur le bouchon (1) tout en le tournant (2) dans le sens contraire des aiguilles d’une montre (vers la gauche).
· 
Vous devez espacer les prises d’au moins 6 heures.
Vous devez utiliser ce médicament uniquement quand la toux survient. Par exemple, pour une toux ne survenant que le soir, une prise unique peut suffire.
Le traitement doit être court (quelques jours).
Si vous avez pris plus de POLERY ADULTES SANS SUCRE, sirop édulcoré à la saccharine sodique et au cyclamate de sodium que vous n’auriez dû ou si un enfant a pris accidentellement ce sirop
Les effets d’un surdosage peuvent être, chez l’adulte et chez l’enfant : des vomissements, un accès de rougeur du visage, un gonflement du visage, une urticaire (sensation ressemblant à une piqûre d’ortie), une éruption cutanée, des difficultés à uriner, un rétrécissement des pupilles, une euphorie ou dysphorie (sentiment de tristesse), une somnolence, une dépression respiratoire soudaine (ralentissement respiratoire d’apparition rapide), une apnée (pauses de la respiration) et une cyanose (diminution de l’oxygénation au niveau de la peau et des muqueuses se traduisant par un aspect bleuté des lèvres et des ongles) des convulsions, un coma, un œdème pulmonaire, une chute importante de la tension (collapsus).
Si l’un de ces effets survient, consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez de prendre POLERY ADULTES SANS SUCRE, sirop édulcoré à la saccharine sodique et au cyclamate de sodium
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre POLERY ADULTES SANS SUCRE, sirop édulcoré à la saccharine sodique et au cyclamate de sodium
En cas de traitement prolongé, l’arrêt brutal de ce médicament peut entraîner un ensemble de symptômes traduisant un état de manque (syndrome de sevrage).
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
Les effets indésirables suivants peuvent survenir avec des fréquences indéterminées (ne peuvent être estimées à partir des données disponibles) :
· somnolence,
· vertige,
· bronchospasme (réduction du calibre des bronches) se traduisant par une gêne respiratoire et une respiration sifflante pouvant être accompagnées par des douleurs dans la poitrine,
· dépressions respiratoires (ralentissement respiratoire / difficultés à respirer),
· douleurs abdominales hautes, surtout chez les personnes qui n’ont plus de vésicule biliaire (cholécystectomie),
· pancréatite (inflammation du pancréas),
· constipation, nausées, vomissements,
· allergie sur la peau. Vous reconnaîtrez une allergie par des boutons, des démangeaisons, des rougeurs sur la peau. Si l’un de ces signes survient, vous devez arrêter le traitement et consulter immédiatement votre médecin.
· Difficultés à uriner.
Liés à la présence de codéine et en cas d’utilisation prolongée :
· Abus, dépendance.
· Un ensemble de symptômes traduisant un état de manque (syndrome de sevrage) en cas d’interruption soudaine.
· Syndrome de sevrage chez le nouveau-né de mère exposée régulièrement au cours de la grossesse.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance- Site internet :
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
· Les substances actives sont :
Codéine……………………………………………................. …………………………………………..11,8 mg
Erysimum (Sisymbrium officinale (L.) Scop.) (extrait fluide hydro-alcoolique (22% V/V) de*).. 442,8 mg
*Rapport drogue/ extrait : 1/0,5 – 2,5
Pour 15 ml de sirop
· Les autres composants sont : Benzoate de sodium (E211), parahydroxybenzoate de méthyle (E218), acide citrique anhydre, arôme noyau*, saccharine sodique, cyclamate de sodium, eau purifiée.
*Composition de l’arôme noyau : benzaldéhyde, alcoolat de framboise, éthanol, eau.
Titre alcoolique volumique du sirop : 1,5 % (V/V).
Voir rubrique 2 « POLERY ADULTES SANS SUCRE, sirop édulcoré à la saccharine sodique et au cyclamate de sodium contient : ».
Les Cauquillous
81500 Lavaur
PIERRE FABRE MEDICAMENT
PARC INDUSTRIEL DE LA CHARTREUSE
81100 CASTRES
SITE PROGIPHARM
RUE DU LYCEE
45500 GIEN
Sans objet.
A compléter ultérieurement par le titulaire
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).





 Sirop (Composition pour 15 ml de sirop)
Sirop (Composition pour 15 ml de sirop)











Avis
Il n’y a pas encore d’avis.